Dans le groupe Cosentyx® 150 mg :
À S16, 40,0 % des patients sont répondeurs ASAS 40 vs 28 % sous placebo
(OR [IC95 %] : 1,77 [1,14 ; 2,74] ; p = 0,0108, groupe Cosentyx® avec dose de charge versus groupe placebo)
Dans le groupe Cosentyx® 150 mg :
À S16, 40,0 % des patients sont répondeurs ASAS 5/6 vs 23,7 % sous placebo
(OR [IC95 %] : 2,26 [1,43 ; 3,58] ; p = 0,0005, groupe Cosentyx® avec dose de charge versus groupe placebo)
Dans le groupe Cosentyx® 150 mg :
À S16, les patients ont présenté une réduction significative du score BASDAI
par rapport à l’inclusion : - 2,35 (± 0,20) vs −1.46 (± 0.21) sous placebo
(Δ [IC95 %] : -0,89 [-1,39 ; -0,38] ; p = 0,0006, groupe Cosentyx® avec dose de charge versus groupe placebo)
Dans le groupe Cosentyx® 150 mg :
À S16, 37,3 % des patients sont répondeurs BASDAI 50 vs 21 % sous placebo
(OR [IC95 %] : 2,53 [1,58 ; 4,07] ; p = 0,0001, groupe Cosentyx® avec dose de charge versus groupe placebo)
Dans le groupe Cosentyx® 150 mg :
À S16, le rapport du taux de hsCRP à S16/taux de hsCRP à l’inclusion était de + 0,64 (± 1,08)vs + 0.91 (± 1.08)
sous placebo
(Effet relatif du traitement [IC95 %] : 0,7 [0,58 ; 0,84] ; p = 0,0002, groupe Cosentyx® avec dose de charge versus groupe placebo)
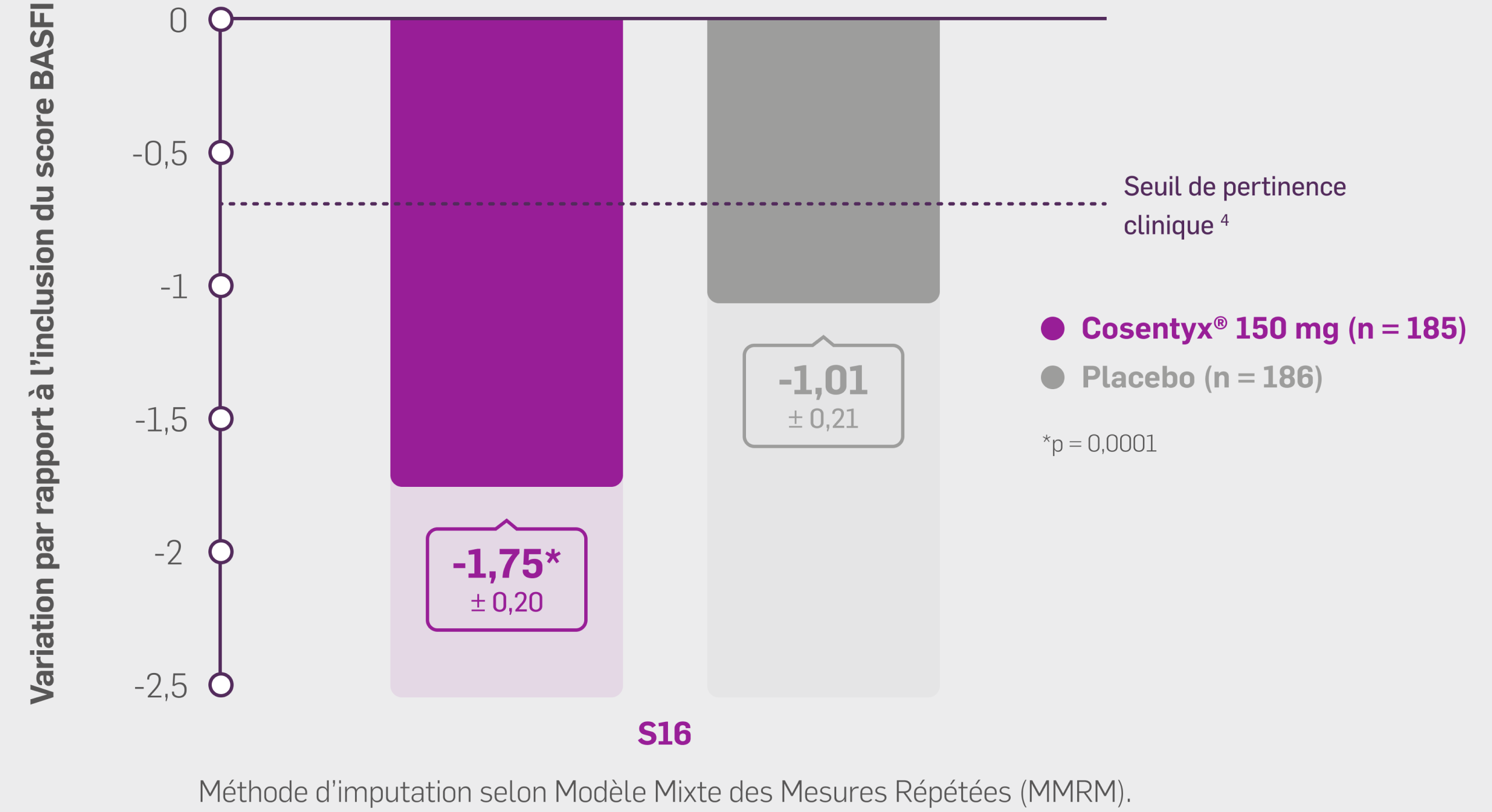
Dans le groupe Cosentyx® 150 mg :
À S16, les patients ont présenté une réduction significative du score BASFI
par rapport à l’inclusion : - 1,75 (± 0,20) vs −1.01 (± 0.21) sous placebo
(Δ sécukinumab – placebo [IC95 %] : 0,75 [-1,26 ; -0,24] ; p : 0,0041, groupe Cosentyx® avec dose de charge versus groupe placebo)
Dans le groupe Cosentyx® 150 mg :
À S16, les patients ont présenté une réduction significative du score de Berlin de l’œdème
des articulations sacro-iliaques par rapport à l’inclusion : - 1,68 (± 0,24) vs 0.39 (± 0.15) sous placebo
(Δ (ES) : -1,24 ± 0,20 ; p < 0,0001, groupe Cosentyx® avec dose de charge versus groupe placebo)
Dans le groupe Cosentyx® 150 mg :
À S16, 56,8 % des patients sont répondeurs ASAS 20 vs 45,7 % sous placebo
(OR [IC95 %] : 1,60 [1,06 ; 2,43] ; p = 0,0260, groupe Cosentyx® avec dose de charge versus groupe placebo)
Dans le groupe Cosentyx® 150 mg :
À S16, les patients ont présenté une amélioration significative du score SF36-PCS
par rapport à l’inclusion : + 5,71 (± 0,68) vs +2.93 (± 0.71) sous placebo
(Δ [IC95 %] : 2,77 [1,20 ; 4,34] ; p = 0,0006, groupe Cosentyx® avec dose de charge versus groupe placebo)
Dans le groupe Cosentyx® 150 mg :
À S16, les patients ont présenté une réduction significative du score ASQoL
par rapport à l’inclusion : - 3,45 (± 0,41) vs −1.84 (± 0.42) sous placebo
(Δ [IC95 %] : -1,61 [-2,54 ; -0,67] ; p = 0,0008, groupe Cosentyx® avec dose de charge versus groupe placebo)
Dans le groupe Cosentyx® 150 mg :
À S16, 21,6 % des patients sont répondeurs ASAS rémission partielle vs 7 % sous placebo
(OR [IC95 %] : 3,80 [1,95 ; 7,39] ; p < 0,0001, groupe Cosentyx® avec dose de charge versus groupe placebo)
Dans le groupe Cosentyx® 150 mg :
À S52, 35,4 % des patients naïfs d'anti-TNF sont répondeurs ASAS 40 vs 19,9 % sous placebo
(p < 0,05, groupe Cosentyx® avec dose de charge versus groupe placebo)